Tags : Acido Ialuronico Filler Labbra
Ecco una sessione Q&A (Questions and answers) incentrata su un trattamento molto diffuso in ambito medico ed otorinolaringoiatrico, ovvero #filler di Acido Ialuronico.
Q) Che cosa è il Filler di Acido Ialuronico?
A) Il Filler è una preparazione farmaceutica a base di Acido Ialuronico esogeno largamente utilizzata in medicina, soprattutto per:
- Definire il contorno delle labbra ed aumentarne il volume, conferendo turgore
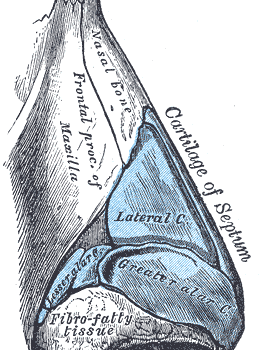
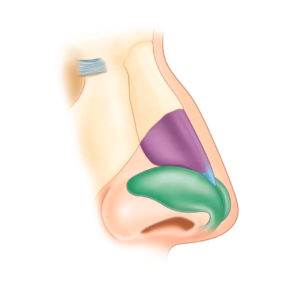
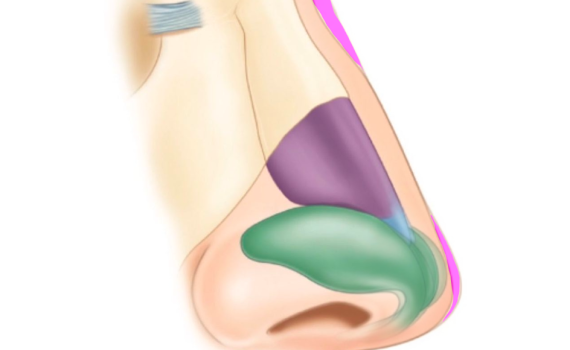
- Rinoplastica non chirurgica (correzione del dorso/gibbo e proiezione della punta), detta rinofiller
- Correggere inestetismi della pelle tipici dell’invecchiamento cutaneo, come rughe e piccole depressioni o solchi
I filler all’acido ialuronico sono iniettati nel derma attraverso apposite siringhe dotate di aghi molto sottili o mediante micro-cannula: le iniezioni di acido ialuronico vengono normalmente eseguite in regime ambulatoriale, e il fastidio percepito durante il trattamento è piuttosto sopportabile.
La vasta disponibilità sul mercato di filler formulati con acido ialuronico a concentrazioni differenti ha permesso di intervenire su svariati fronti e soddisfare molteplici richieste estetiche, spaziando dalla correzione delle piccole rughe d’espressione all’aumento volumetrico di labbra ed altre aree del viso.
Q) Che cosa è l’Acido Ialuronico?
A) L’Acido Ialuronco è un componente della sostanza fondamentale del derma: si tratta di un glicosaminoglicano (GAG), ovvero una molecola formata da lunghe catene non ramificate di unità disaccaridiche (alternanza di acido glucuronico ed N-acetilglucosamina). Legandosi a moltissime molecole d’acqua, l’Acido Ialuronico conferisce idratazione, elasticità e morbidezza ai tessuti, proteggendoli nel contempo da sollecitazioni eccessive.
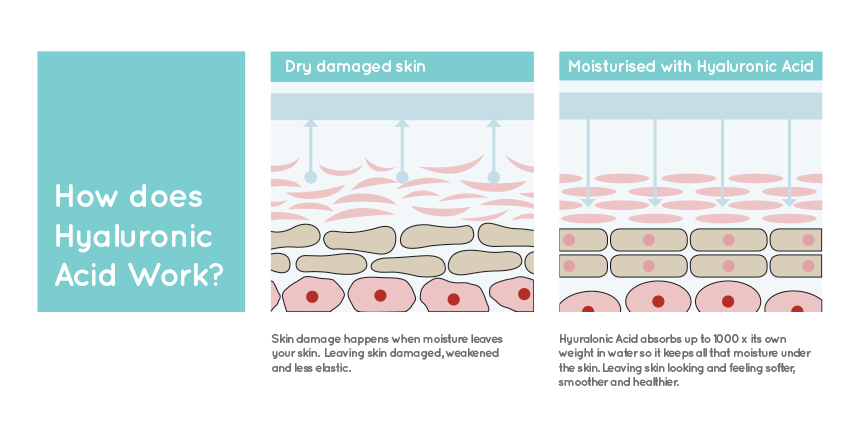
Q) In quali casi si può impiegare il Filler?
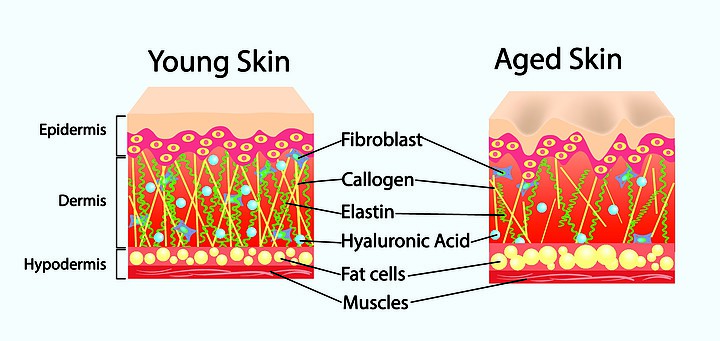
A) Il Filler di Acido Ialuronico è una soluzione ideale per correggere o migliorare inestetismi della pelle del volto, generati dall’invecchiamento: un percorso evolutivo irreversibile che tanto preoccupa molte donne non più giovanissime.
Il Filler di Acido Ialuronico trova indicazione nelle seguenti circostanze:
- Definire il contorno delle labbra ed aumentarne il volume, conferendo turgore
- Rinoplastica non chirurgica (correzione del dorso/gibbo e proiezione della punta) detta #rinofiller
- Correggere piccole lesioni cicatriziali (es. cicatrici lasciate dall’acne o post-traumatici/chirurgici)
- Volumizzare zigomi cadenti (in tal caso, il filler deve avere una concentrazione più elevata di AI)
- Rimodellamento del profilo del volto
- Plasmare rughe d’espressione, zampe di gallina, rughe glabellari
Q) Quanti tipi di Filler di Acido Ialuronico esistono?
A) In base alla durata media si possono dividere in:
- Riassorbimento ultra-rapido: 2-3 mesi
- Riassorbimento medio: 5-6 mesi
- Riassorbimento lento: fino a 12 mesi
- Riassorbimento ultra-lento: fino a 24 mesi
Q) Quali sono le tecniche di iniezione del Filler?
A) L’iniezione di Filler di Acido Ialuronico è un trattamento non invasivo relativamente semplice da eseguire, che deve essere eseguito solo da personale medico specializzato in quest’ambito.
Naturalmente, prima di eseguire l’iniezione, è necessario effettuare una visita preliminare con lo specialista, al fine di valutare le condizioni di partenza della regione da trattare, analizzare le aspettative del paziente e discutere le modalità del trattamento.
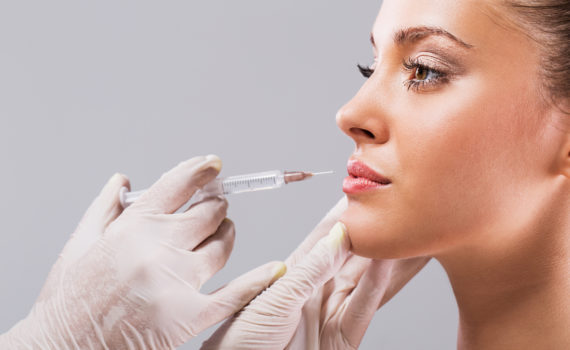
Labbra
- Definizione del contorno: tecnica di infiltrazione lineare retrograda, tecnica delle micro-infiltrazioni puntiformi
- Riempimento di volume: tecnica delle micro-infiltrazioni puntiformi
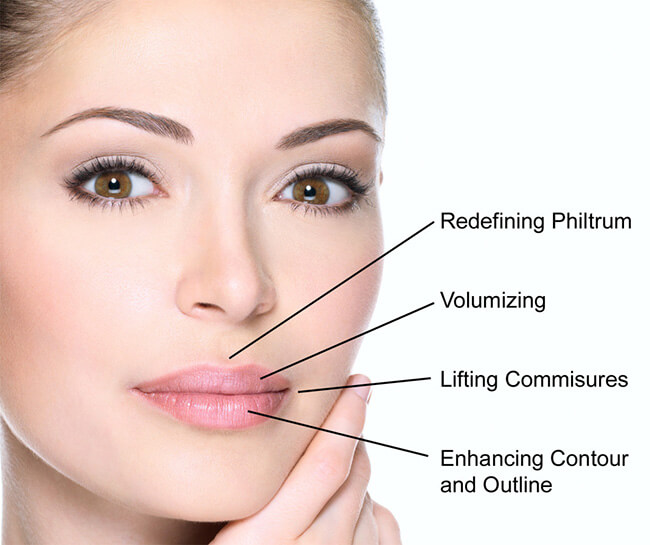
Trattamento delle labbra: definizione del contorno ed aumento di volume
Naso
Il paziente tipo da sottoporre a rinofiller ha lievi imperfezioni del profilo del dorso nasale: le più frequenti includono il gibbo, una sfumata deviazione dell’asse della piramide nasale, un’asimmetria delle linee estetiche del dorso, un lieve deficit di proiezione o rotazione della punta. Altre condizioni che possono essere trattate sono la presenza di un angolo naso-labiale acuto, un dorso molto convesso, un angolo naso-frontale ridotto, un ridotto sviluppo della columella con caduta della punta.
Volto
- Biostimolazione/biorivitalizzazione: ringiovanimento del volto mediante stimolazione della sintesi del collagene endogeno e reidratazione del derma con tecnica della micro-cannula

Biorivitalizzazione
Q) Quali risultati mi posso aspettare?
A) I risultati ottenibili con i Filler di Acido Ialuronico sono buoni e riscuotono un buon livello di soddisfazione dei pazienti. Questi trattamenti, infatti, permettono di ottenere un ringiovanimento e un aumento di volume del tutto naturale che non conferisce artificialità all’area del volto o del corpo nel quale vengono eseguiti (effetto soft-lifting). Inoltre, i risultati sono visibili fin da subito e ciò aumenta la soddisfazione dei pazienti.
Tuttavia, pur essendo pressoché immediati, gli effetti di ringiovanimento estetico della pelle generati dal Filler di Acido Ialuronico non sono permanenti; infatti dopo un periodo di tempo relativamente breve (variabile da 4 mesi a 2 anni, in funzione del tipo di filler utilizzato), le rughe iniziano nuovamente a comparire, e le labbra (gli zigomi o le altre parti del volto e del corpo trattate) perdono progressivamente il loro volume. Ciò avviene perché l’organismo è in grado di metabolizzare l’Acido Ialuronico iniettato (da qui il nome di “Filler riassorbibile”).
Il graduale riassorbimento del Filler da parte dell’organismo rende, pertanto, necessaria la periodica ripetizione delle iniezioni di Acido Ialuronico dopo la scomparsa dell’effetto.
Q) Quali sono i possibili effetti collaterali?
A) Eritema (arrossamento), edema (gonfiore), ematoma (stravaso di sangue), dolore, prurito: sono comuni e si manifestano immediatamente
-Non infiammatorie: nodulo
-Infiammatorie: infezione, nodulo precoce, nodulo tardivo (>2 settimane), granuloma (incidenza 0,1-0,01%)
Q) Ci sono svantaggi?
A) Oltre all’eventuale dolore percepito durante le iniezioni, alla potenziale comparsa di effetti collaterali e/o reazioni allergiche e alla creazione di una possibile “dipendenza” da Acido Ialuronico.
Q) Quali sono le controindicazioni al Filler?
A) Sebbene gli effetti collaterali gravi derivati dalle iniezioni di Acido Ialuronico siano poco frequenti, si sconsiglia vivamente di somministrare il Filler durante la gravidanza e l’allattamento. Inoltre, il Filler di Acido Ialuronico è controindicato in presenza di malattie della pelle, infezione da Herpes, patologie autoimmuni della cute e del collagene.
Q) Come mantenere il risultato del Filler stabile nel tempo?
A) Premesso che alcune abitudini comportamentali scorrette – quali consumare eccessivamente alcolici, fumare o non praticare alcuna forma di sport – possano diminuire la durata dell’effetto soft-lifting promosso dal Filler di Acido Ialuronico, è possibile prolungare e potenziarne l’effetto anti-aging applicando regolarmente prodotti specifici antirughe, arricchiti di sostanze cosmetiche ad azione idratante ed emolliente – come allantoina, pantenolo e lipidi eudermici insaturi – ed antiossidanti, come la Vitamina C, la Vitamina E, l’Acido lipoico e la Vitamina A palmitato.
Il Dott. Gennaro Russo è Dirigente Medico presso la UOC Otorinolaringoiatria e Chirurgia Cervico-Facciale dell’Ospedale Monaldi di Napoli. Svolge attività clinica, chirurgica e di ricerca su chirurgia oncologica e disturbi dell’equilibrio.