Ipoacusia: quando l’impianto cocleare?
Ipoacusia e Impianto Cocleare: quando?
Ipoacusia
La causa principale di ipoacusia è legata al danno o alla distruzione delle cellule ciliate acustiche, strutture vulnerabili e suscettibili di una varietà di danni, di natura genetica, infettiva (rosolia e meningite), da trauma acustico, iatrogena (kanamicina, streptomicina, cisplatino) e da invecchiamento.
La mancanza di cellule ciliate interrompe le connessioni afferenti ed efferenti tra coclea e vie/aree uditive centrali, pertanto il danno neurosensoriale è irreversibile e non suscettibile di terapia medica. Nella coclea di un soggetto con ipoacusia, in mancanza di stimolazione delle cellule ciliate, la parte più periferica del neurone (del nervo acustico) compresa tra il corpo cellulare nel ganglio spirale e la parte terminale a livello dell’organo del Corti, va incontro a degenerazione retrograda e cessa di funzionare. I neuroni che sopravvivono a questo processo, costituiscono i siti utili all’eccitazione da parte dell’IC.
Impianto Cocleare
I pazienti affetti da ipoacusia possono essere avviati alla protesizzazione acustica tradizionale, con protesi acustiche. Nel caso di un’ipoacusia grave-profonda però, l’entità della sordità può essere tale da far sì che il rendimento protesico sia insufficiente a garantire delle performances uditive e comunicative soddisfacenti. Questi casi possono essere candidabili alla procedura di impianto cocleare (IC).
La procedura di IC è consolidata e attualmente gli impianti cocleari rappresentano una importante soluzione per il recupero sociale e la riabilitazione di pazienti adulti con sordità grave-profonda e per la riabilitazione del bambino sordo profondo. Secondo un report della US Food and Drug Administration (FDA), fino a dicembre 2010 circa 219.000 pazienti nel mondo sono stati sottoposti ad impianto cocleare. Negli Stati Uniti il totale dei pazienti impiantati è pari a 42.600 per gli adulti e 28.400 per i bambini. In Italia si stima che siano presenti circa 6-7.000 pazienti impiantati, con circa 700 interventi di IC per anno, equamente distribuiti tra adulti e bambini. Dei pazienti impiantati, ogni anno circa il 10% sono sottoposti ad impianto cocleare bilaterale.
I risultati sono ottimi, se pur con differenze tra individuo e individuo, nei pazienti adulti, nei quali migliorano significativamente le capacità comunicative (compreso in alcuni casi l’uso del telefono, l’ascolto della televisione e della musica), con effetti positivi di carattere psicologico, sociale e lavorativo. In campo pediatrico, nei bambini affetti da ipoacusia profonda, non suscettibili di risultati con la protesizzazione acustica tradizionale, se eseguito precocemente, consente uno sviluppo ottimale sia delle abilità uditive sia del linguaggio, consentendo così un adeguato sviluppo delle facoltà comunicative e intellettive del bambino. In tale popolazione, nel caso di insorgenza pre-verbale dell’ipoacusia, esiste un periodo critico per lo sviluppo delle abilità linguistiche, sotteso dalla plasticità neuronale e strettamente dipendente dalla presenza di un adeguata stimolazione uditiva, che condiziona la necessità di un intervento precoce per prevenire la comparsa di un ritardo nello sviluppo del linguaggio sia sul versante percettivo che espressivo. I risultati dell’IC, sebbene straordinari, sono ancora condizionati da un elevato numero di variabili, molte delle quali altamente interrelate e agenti in misura differente in età diverse, quali durata della deprivazione uditiva, funzionalità uditiva residua, presenza di disabilità associate, modalità di comunicazione e riabilitazione logopedica.
L’IC è il primo organo di senso artificiale capace di evocare sensazioni acustiche stimolando direttamente l’orecchio interno. L’IC è una protesi che è inserita chirurgicamente nell’orecchio interno e stimola elettricamente le fibre del nervo acustico. La FDA, punto di riferimento per le agenzie governative di tutti i paesi del mondo, ha approvato l’utilizzo degli impianti cocleari negli adulti nel 1984 e nei bambini nel 1990.
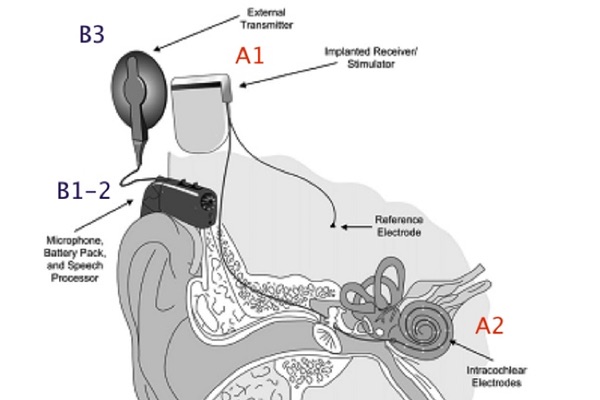
L’IC è composto da una parte impiantata chirurgicamente all’interno della coclea (A) e dotata di una bobina magnetica posizionata al di sotto dello scalpo (A1) e di una componente esterna (B), dotata di un microfono (B1), di un processore (B2) e di una antenna trasmettitrice (B3), come illustrato in figura.
A1 Il ricevitore/stimolatore decodifica il segnale ricevuto dall’antenna trasmettitrice (B3) in un treno di impulsi elettrici, che vengono trasmessi, attraverso i cavetti, all’array di elettrodi (A2) che viene posizionato nella scala timpanica della coclea.
A2 Gli elettrodi sono in numero e morfologia variabile, così come l’array ha dimensioni e morfologia differenti nei vari tipi di impianto.
B1 Il microfono è agganciato al padiglione auricolare con una comune curvetta ed ha la funzione di captare i suoni ambientali ed inviarli al processore; B2 Il processore o elaboratore del segnale riceve i segnali dal microfono, processa il suono, attraverso le più recenti strategie di elaborazione, che sono generalmente diverse nei modelli proposti dalle varie case costruttrici, lo converte in un particolare codice elettrico, che viene inviato, tramite l’antenna (B3) al ricevitore/stimolatore (A1) e quindi come impulsi elettrici agli elettrodi intracocleari (A2) ed al nervo acustico;
B3 L’antenna trasmettitrice è direttamente in contatto con il cuoio capelluto e contiene un magnete che ne assicura il corretto posizionamento rispetto alla parte impiantata. Essa invia il segnale codificato, attraverso la cute, al ricevitore/stimolatore (A1) interno tramite radiofrequenze, che ne garantiscono anche l’alimentazione.
Le componenti interne invece sono il ricevitore/stimolatore (A1) e l’array di elettrodi (A2).
Un recente IC ha la particolarità di avere tutte le componenti esterne (B1-2-3) in un unico device.
In conclusione, il processo complessivo che porta il paziente portatore di impianto alla percezione uditiva, passa per la necessaria fase di adattamento o mappaggio. Questa può durare anche molti mesi in quanto le resistenze elettriche si modificano in un largo intervallo di tempo, così come le risposte soggettive del paziente. Questo fitting dipende da molte variabili anche inerenti la clinica delle ipoacusie.
Bibliografia
Alice B, Silvia M, Laura G, et al. Cochlear implantation in the elderly: surgical and hearing outcomes. BMC Surg. 2013;13 Suppl 2:S1.
American Speech-Language-Hearing Association, 2004. Scope of Practice in Audiology [Scope of Practice].
American Speech-Language-Hearing Association, 2004. Cochlear implants [Technical Report].
Arndt S, Aschendorff A, Laszig R, et al. Comparison of pseudobinaural hearing to real binaural hearing rehabilitation after cochlear implantation in patients with unilateral deafness and tinnitus. Otol Neurotol. 2011 Jan;32(1):39-47.
Arsenault MD, Punch JL. Nonsense-syllable recognition in noise using monaural and binaural listening strategies. J Acoust Soc Am. 1999 Mar;105(3):1821-30.
Buchman CA, Roush PA, Teagle HF, et al. Auditory neuropathy characteristics in children with cochlear nerve deficiency. Ear Hear. 2006 Aug;27(4):399-408.
Conel, J. L. (1939–1967). The postnatal development of the human cerebral cortex (Vol. 1–8). Cambridge, MA: Harvard University Press.
Dawson PW, Skok M, Clark GM. The effect of loudness imbalance between electrodes in cochlear implant users. Ear Hear. 1997;18:156-65.
Dillon, H. 2002. Hearing Aids(1st ed.). Norwood: Boomerang Press.
Gilley PM, Sharma A, Dorman MF. Cortical reorganization in children with cochlear implants. Brain Res. 2008 Nov 6;1239:56-65.
Giraudet F, Avan P. Auditory neuropathies: understanding their pathogenesis to illuminate intervention strategies. Curr Opin Neurol. 2012 Feb;25(1):50-6.
Gordon K, Papsin BC, Harrison RV. Programming cochlear implant stimulation levels in infants and children with a combination of objective measures. Int J Audiol. 2004 Dec;43 Suppl 1:S28-32.
Helms J, Müller J, Schön F, et al. Evaluation of performance with the COMBI40 cochlear implant in adults: a multicentric clinical study. ORL J Otorhinolaryngol Relat Spec. 1997 Jan-Feb;59(1):23-35.
Helms J, Müller J, Schön F, et al. Comparison of the TEMPO+ ear-level speech processor and the cis pro+ body-worn processor in adult MED-EL cochlear implant users. ORL J Otorhinolaryngol Relat Spec. 2001 Jan-Feb;63(1):31-40.
Huttenlocher PR, Dabholkar AS. Regional differences in synaptogenesis in human cerebral cortex. J Comp Neurol. 1997 Oct 20;387(2):167-78.
Kiefer J, Gstoettner W, Baumgartner W, Pok SM, Tillein J, Ye Q, von Ilberg C. Conservation of low-frequency hearing in cochlear implantation. Acta Otolaryngol. 2004 Apr;124(3):272-80.
Kim AH, Kileny PR, Arts HA, et al. Role of electrically evoked auditory brainstem response in cochlear implantation of children with inner ear malformations. Otol Neurotol. 2008 Aug;29(5):626-34.
Kral A, Sharma A. Developmental neuroplasticity after cochlear implantation. Trends Neurosci. 2012 Feb;35(2):111-22.
Kral A. Auditory critical periods: a review from system’s perspective. Neuroscience. 2013 Sep 5;247:117-33.
NICDC Fact Sheet: Cochlear implants, NIH Pubblication N. 11-4798, Updated March 2011.
Quaderni monografici di aggiornamento AOOI: Impianti Cocleari, 2009
Sampaio AL, Araújo MF, Oliveira CA. New criteria of indication and selection of patients to cochlear implant. Int J Otolaryngol. 2011;2011:573968.
Schindler A, Di Gioia F, Schindler O
UK Cochlear Implant Study Group. Criteria of candidacy for unilateral cochlear implantation in postlingually deafened adults II: cost-effectiveness analysis. Ear Hear. 2004 Aug;25(4):336-60.
Wilson B, Dorman MF. Cochlear implants: A remarkable past and a brilliant future. Hearing Research 242:3-21, 2008.

Il Dott. Gennaro Russo è Dirigente Medico presso la UOC Otorinolaringoiatria e Chirurgia Cervico-Facciale dell’Ospedale Monaldi di Napoli. Svolge attività clinica, chirurgica e di ricerca su chirurgia oncologica e disturbi dell’equilibrio.